
文章简介
高纯度氧气广泛应用于众多行业,并且绝大多数气体是通过空气低温蒸馏产生的,这是一个资本和能源极其集中的过程。人们对开发O2选择性空气分离新方法非常感兴趣,包括使用多孔结晶金属有机框架,该框架具有配位不饱和金属位点,可以通过电子转移选择性地结合O2而不是 N2。然而,大多数这些材料仅在低温下表现出明显或可逆的O2吸收,并且它们的开放金属位点也是空气中存在的水的潜在强结合位点。在这里,美国加州大学伯克利分校Jeffrey R. Long教授课题组开发了一种优化的材料合成方法合成了CuI-MFU-4l (CuxZn5−xCl4−x(btdd)3;H2btdd=bis(1H-1,2,3-triazolo[4,5-b],[4′,5′-i])dibenzo[1,4]dioxin),获得了高密度的三角锥体 CuI位点,已被证明在环境温度下可逆地结合 O2。并且我们表明,即使在有水存在的情况下,这种材料也能在25 °C下可逆地捕获空气中的O2。当暴露于不同湿度水平的空气中时,CuI-MFU-4l 在动态突破条件下的重复循环过程中保留了良好的O2容量。虽然该材料还同时吸附 N2,但O2和N2解吸动力学的差异允许在相对温和的再生条件下分离高纯度O2 (>99%)。有趣的是,光谱、磁性和计算分析表明,O2与铜 (I) 位点结合形成铜 (II)-超氧化物部分,该部分表现出温度依赖性的侧向和端向结合模式。总的来说,这些结果表明 CuI -MFU-4l 是一种很有前途的材料,即使不除湿,也可以从环境空气中分离O2。
背景介绍
富集或高纯度O2是医疗、制造和航空航天工业以及环氧乙烷和邻苯二甲酸酐等原料化学品生产中的关键商品。绝大多数O2是通过低温蒸馏空气生产出来的。这个多步骤过程包括对空气进行压缩和预处理,以去除挥发性有机化合物、水和二氧化碳,然后生成的气体混合物(主要是O2、N2和Ar)在经过一系列的过程后膨胀并冷却至低温,然后送入蒸馏塔,其中O2与N2和Ar分离(图 1a)。虽然低温蒸馏是最成熟和最广泛使用的空气分离技术,但人们对寻找更节能和可扩展的从空气中分离氧气的方法有着浓厚的兴趣。从分子钴 (II) 配合物中O2结合的早期研究开始,使用O2选择性吸附剂进行节能空气分离的前景几十年来一直受到研究关注。在过去的十年里,这一领域出现了复兴,发现某些多孔微晶金属有机框架(MOF)具有配位不饱和铁(II)、钴(II)、和铬(II)位点可以通过电子转移机制结合O2,相对于典型的氧化还原惰性N2,O2具有优异的选择性。重要的是,使用阳离子交换沸石选择性吸附N2而不是O2(和 Ar)的空气分离已在工业中用于补充低温蒸馏,适用于O2纯度 <95% 就足够的应用(例如用于医药用途)。因此,特别是对于中小型应用,基础设施已经到位,原则上可以适应使用O2选择性吸附剂实施分离技术。
图文解析
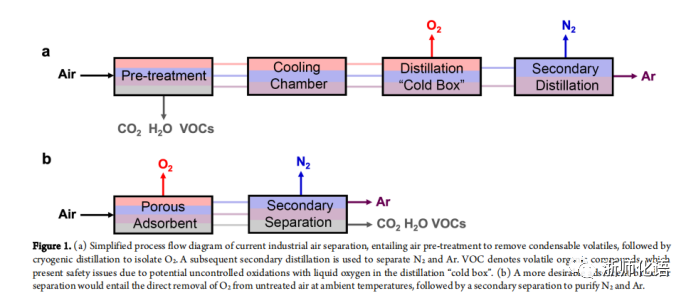
要点:工业上分离纯化O2的方法主要是对空气进行压缩和预处理,以去除挥发性有机化合物、水和二氧化碳,然后生成的气体混合物(主要是O2、N2和Ar)在经过一系列的过程后膨胀并冷却至低温,然后送入蒸馏塔,进一步分离O2和N2、Ar(图1a)。而更理想的分离方法是利用吸附剂直接吸附分离空气中的O2,然后进行二次分离以纯化N2和Ar(图1b)。
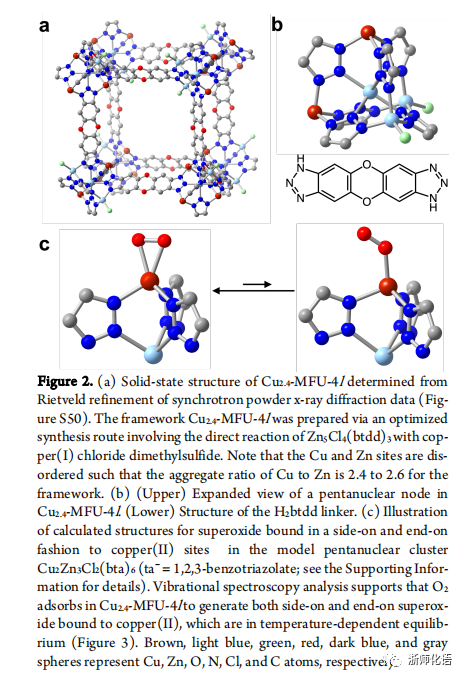
要点:CuI-MFU-4l 主要由五核簇节点和H2btdd组成,其中五核簇节点由中心八面体锌(II)离子与四个外围金属离子(金字塔形铜(I)或金字塔形铜(II)或四面体锌(II)组成。通过不同的合成方法可合成含有不同铜(I)粒子数的五核簇节点,因此五核簇节点是无序的(图2a,b)。O2在铜 (I) 位点结合形成铜(II)-超氧化物,并且有侧向和端向两种结合模式,并且这两种结合模式在一定温度范围内达到平衡(图2c)。
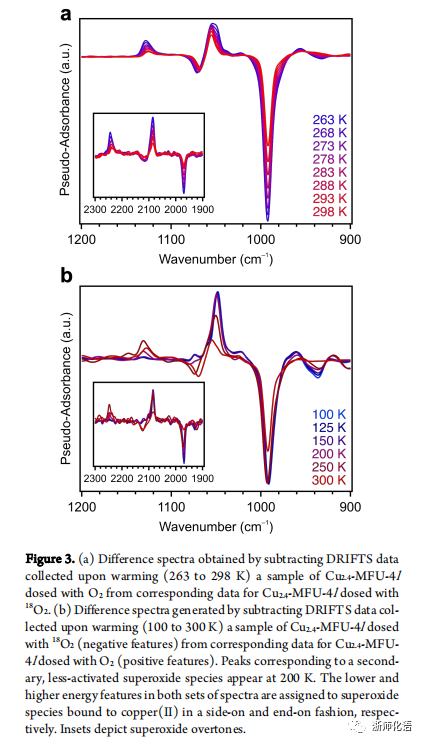
要点:DRIFTS分析结果表明,温度从263K升到298K时,在1131和1051 cm−1处以及在1073和993 cm−1处出现两组峰,分别对应超氧化物结合端向(η1)到 CuII和超氧化物结合侧向(η1)到CuII的峰(图3a)。当温度为100K时,仅存在1051 和 993 cm−1处的峰,表明在较低温度下O2难以和端向的CuI结合(图3b)。
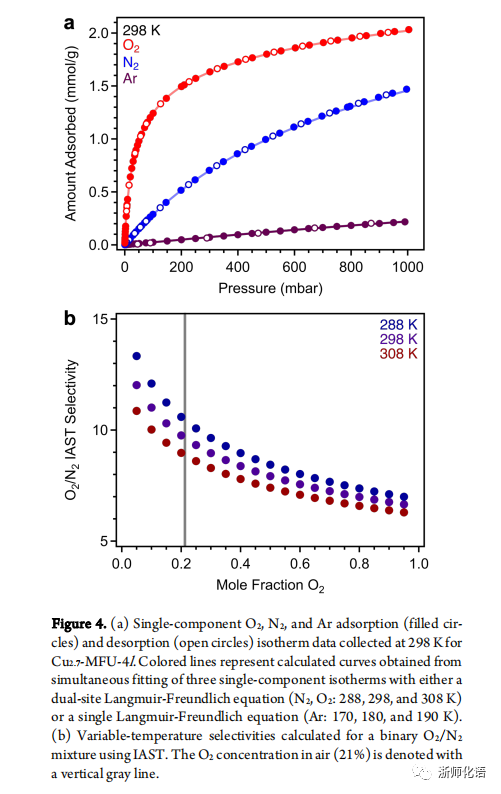
要点:图4a为 Cu2.7 -MFU-4l 在 298 K 和 0–1 bar 压力范围内的单组分O2、N2和Ar 吸附等温线。该MOF在低压下表现出相对陡峭的O2吸附,并在210 mbar(空气中O2分压)下达到 1.51 mmol/g 的容量。在较高压力下吸收开始趋于平稳,在 1 bar下达到 2.03 mmol/g。该MOF在整个压力范围内吸附的N2少于O2(1 bar下为1.47 mmol/g)。然而,在空气中N2分压 (780 mbar) 下,该材料的N2容量为1.30 mmol/g ,仅略低于 210 mbar下的O2容量。而Cu2.7 -MFU-4l对Ar基本不吸附。对于于含有 21% O2的二元混合物,298 K时O2/N2的IAST选择性为10(图4b)。
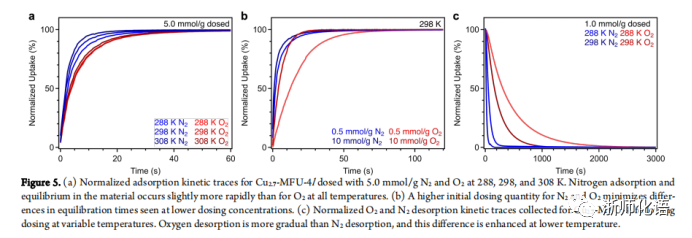
要点:图5为Cu2.7-MFU-4l在288、298和308 K温度下O2和N2吸附和解吸的动力学曲线。当浓度为0.5 mmol/g时,O2和N2的吸附迅速发生,随着温度的升高吸附速率也在增加,但总体来说N2的吸附速率比O2的吸附速率快(图5a)。当两种气体浓度均为1.0mmol/g时,两种气体的吸附速率相差不大(图5b)。变温下O2和N2解吸动力学曲线结果表明O2从材料中解吸比N2解吸更缓慢,表明O2的活化能(Ea = 45kJ/mol)比N2的活化能(Ea = 30kJ/mol)高,因此O2较难脱附(图5c)。
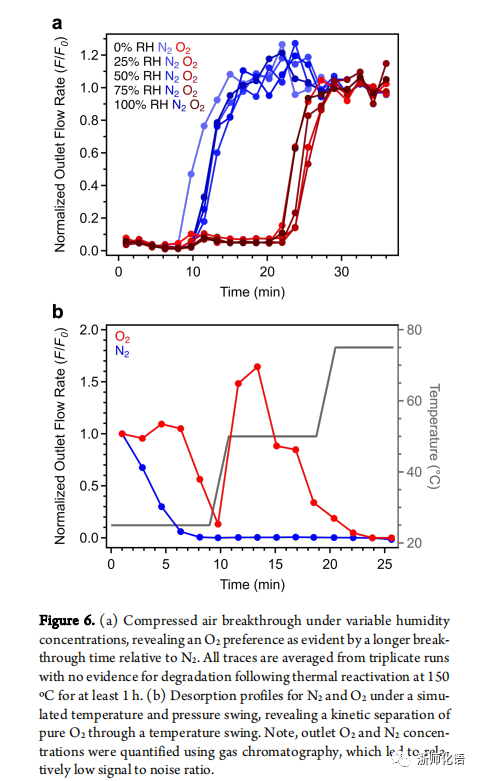
要点:穿透实验结果表明,当Cu2.7 -MFU-4l暴露在干燥空气中时,N2在10min时发生穿透,而O2在20min才开始被洗脱,随着相对湿度的增加,两种气体的穿透时间基本没有发生变化,表明Cu2.7 -MFU-4l在潮湿条件下具有良好的稳定性以及分离潜力(图6a)。在程序升温解吸过程中,N2在25℃时被解吸出来,而O2在50℃时才被解吸出来,表明在室温下便可实现O2/N2的分离(图6b)。
总结与展望
我们优化了众所周知的金属有机骨架 CuI -MFU-4l 的合成,并研究了其在水蒸气存在下与空气中捕获O2捕获的各种条件下的O2结合特性。光谱、磁性和计算分析表明,铜(I)位点通过电子转移与O2结合,形成铜(II)-超氧化物。有趣的是,超氧部分以侧向和端向模式结合在铜(II)位点上,并且这些模式在一定温度范围内处于平衡状态。穿透的循环实验表明,该材料在干燥和潮湿的气流下能够稳定地长期循环,并在有水的情况下可逆地从环境空气中捕获氧气。虽然在这些条件下O2和N2都会快速吸附在材料中,但O2解吸的活化势垒高于N2解吸的活化势垒,并且可以利用这一特性在初始N2解吸后获得高纯度O2 (>99%)。穿透分析进一步表明,材料的O2容量不受湿度影响,这表明共吸附的水不会与暴露的CuI位点结合。这些结果凸显了在MOF中使用铜(I)位点在水存在下选择性捕获O2的优势。此外,虽然传统上在用于O2选择性空气分离的候选 MOF中寻求对O2的高吸附选择性,但我们的结果表明,即使吸附行为表明对O2的选择性相对较低,解吸动力学的差异也可用于获得高纯度O2。这一发现表明,根据对O2和N2吸附行为的初步分析,重新研究那些被忽视的现有材料可能是值得的。我们的实验室正在进行研究,以进一步推进CuI -MFU-4l 用于实际空气分离,包括扩大此处开发的材料以及研究疏水性聚合物涂层以最大限度地减少水的吸附。
Link:https://doi.org/10.26434/chemrxiv-2023-21gn7
开云(中国)Kaiyun·官方网站 吸附表征 全系列测试方案

1、填写《在线送样单》
2、测样、送检咨询:杨老师13810512843(同微信)

















